5. 顕微鏡技術と培養表面:
完璧な組み合わせを見つける
底面素材と光学顕微鏡技術との
適合性
| ibidi 高分子 カバースリップ |
ibidi ガラス カバースリップ |
標準ポリスチレン プレート およびディッシュ |
|
|---|---|---|---|
| 位相差顕微鏡 | ++ | ++ | ++ |
| 微分干渉(DIC)顕微鏡 | ++ | ++ | - |
| 広視野蛍光顕微鏡 | ++ | ++ | - |
| 共焦点顕微鏡 | ++ | ++ | - |
| 二光子顕微鏡(多光子顕微鏡) | ++ | ++ | - |
| FRAP(光褪色後蛍光回復法) | ++ | ++ | - |
| FRET(フェルスター共鳴エネルギー遷移) | ++ | ++ | - |
| FLIM(蛍光寿命イメージング) | ++ | ++ | - |
| 全反射照明蛍光顕微鏡(TIRF) | + | ++ | - |
| 超解像顕微鏡観察 | + | ++ | - |
倒立顕微鏡
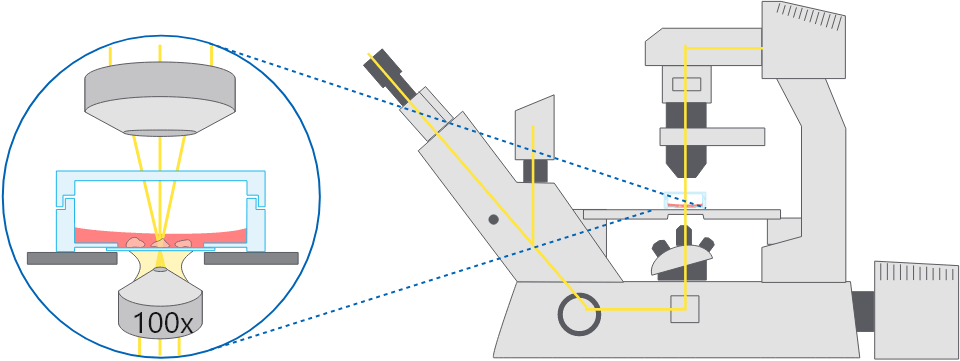 倒立顕微鏡の模式図。容器底面を介して細胞を観察する。
倒立顕微鏡の模式図。容器底面を介して細胞を観察する。 用途:
倒立顕微鏡は、生細胞イメージングのための非常に一般的な技術であり、細胞を細胞培養容器の底部を通して観察することになります。
この技術は、正立顕微鏡と比較した場合いくつかの利点があります。倒立型顕微鏡では、細胞が接着する底面側より、直接開口数の大きい対物レンズを容易に接近させることができます。また、培地を入れた容器内の細胞観察にも容易にできます。このため、高倍率のライブセルイメージングに適しています。また、培地交換など、顕鏡しながら操作しやすい点もメリットになります。そして、対物レンズを上面から接近させる必要がないため、無菌性を保つことが容易であることも重要なメリットです。
原理:
ibidi Solution
- すべてのibidi マイクロスライド、 マイクロディッシュ、 マイクロプレートは、倒立顕微鏡の使用を前提に設計されています。
- ibidi では、倒立顕微鏡対応、ヒーティングシステム/ガスインキュベーションシステムも販売しています。このシステムは、マルチウェルプレートホルダーを使用することで、プレートの観察にも使用できます。
正立顕微鏡
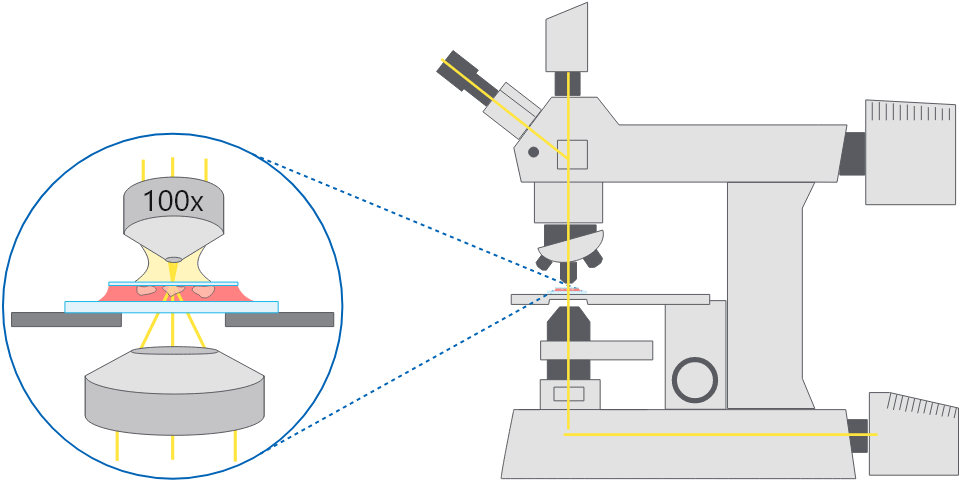 正立顕微鏡の模式図。
正立顕微鏡の模式図。スライドとカバーガラス封入した細胞を上面から観察する。
用途:
正立顕微鏡を生物研究で使用する場合、位相差顕微鏡観察または広視野蛍光顕微鏡観察であることがく、ライブセルイメージングや染色したスライドに封入した組織切片観察などに用いられます。
正立顕微鏡観察は、倒立顕微鏡観察と比較するといくつかの欠点があります。
ライブセルイメージングに使用する場合、培地、容器の蓋/フレームなどの影響で、サンプル上面よりレンズを近接させることが難しく、作動距離が短い高倍率レンズの使用が難しくなります。このため、取得画像の解像度は低く、取得蛍光シグナルは弱くなりがちになります。このため、ibidiではライブセルイメージングでは倒立顕微鏡を推奨しています。
原理:
ibidi Solution
- リムーバブルチャンバー(3 ウェル | 8 ウェル |12 ウェル)は、フレーム部を外し、普通のスライドとして利用できるので、正立顕微鏡にも適合します。
- マイクロスライド VI - フラットは、上部突起がない構造のスライドであり、正立顕微鏡観察にも適合します。
位相差顕微鏡
用途:
原理:
位相差顕微鏡は、細胞を通過した光を回収し、細胞の厚みや構造の違いによって生じる小さな位相の差を、像のコントラストとして捉える手法です。
培地のメニスカスによる違いも、コントラストとして反映されてしまうため、メニスカスは、透過光の位相を乱し、正確な位相差画像取得の阻害要因となります。
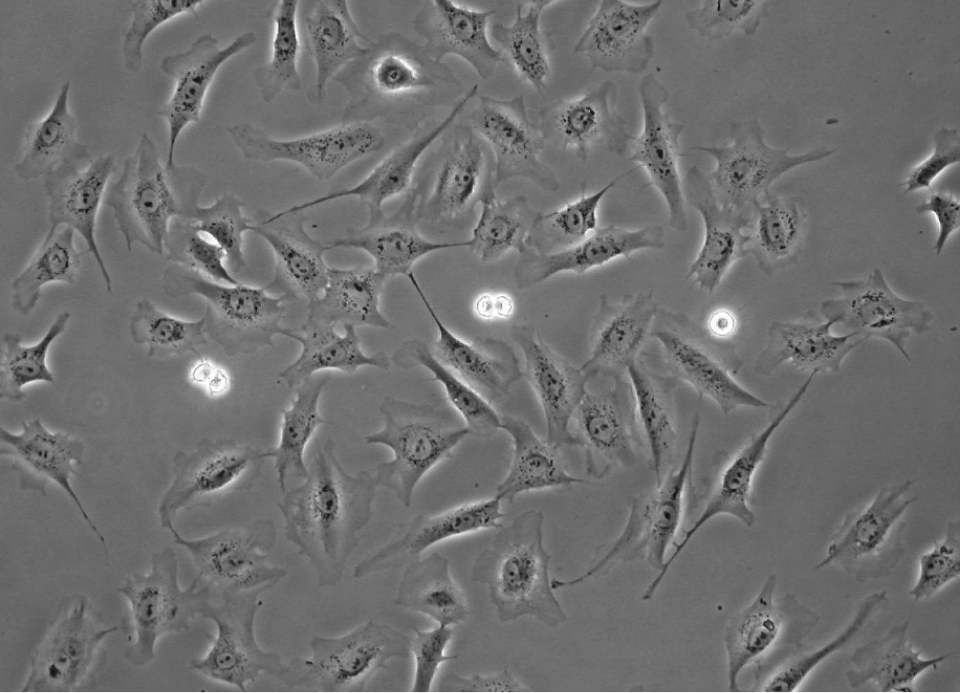 Rat1細胞の位相差顕微鏡
Rat1細胞の位相差顕微鏡 - Physica, 1942, part I: 10.1016/S0031-8914(42)80035-X, part II:10.1016/
S0031-8914(42)80079-8. - E. Horn, R Zantl. Phase-Contrast Light Microscopy of Living CellsCultured in Small Volumes. Microsc Anal, 2006, 20(3):5-7
ibidi Solution
-
位相差顕微鏡観察では、気-液界面に形成されるメニスカスは、画質を著しく低下させる要因になります。メニスカスは、ウェルが小さい程、影響が大きく、96ウェルプレートなどでは特に注意が必要になります。メニスカスにより生じた光の回折が位相を乱し、光路上の位相リングと位相板の正しい関係を狂わせます。
ibidi は優れた位相差画像を保証できるいくつか製品を提案できます。:
詳細は「チャネルスライド」、アプリケーションノート03(PDF)も併せて参照ください。
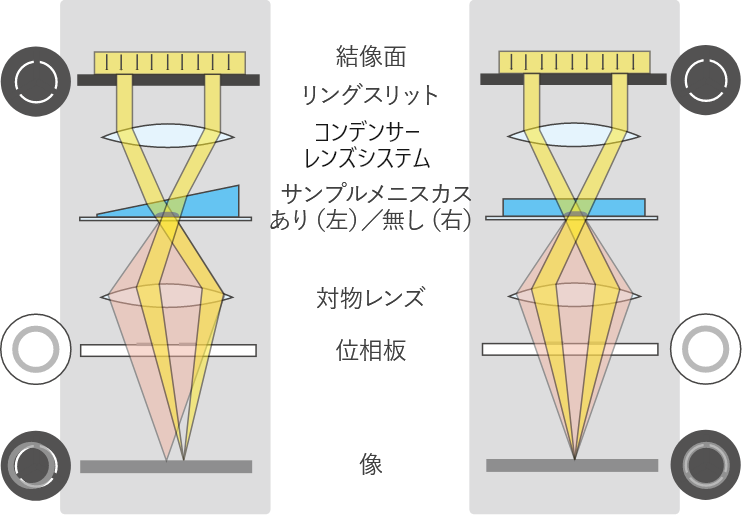
-
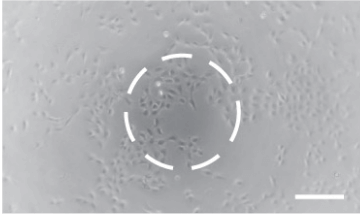 メニスカスありアラインメントなし、
メニスカスありアラインメントなし、
位相差不良。 -
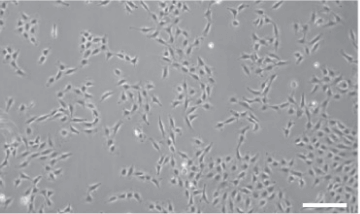 メメニスカス無し正しいアライメント、
メメニスカス無し正しいアライメント、
良好な位相コントラスト。
-
-
ibidi マイクロスライドアンジオジェネシスとマイクロプレートアンジオジェネシス
マイクロスライドアンジオジェネシス および マイクロプレートアンジオジェネシス96ウェルの「内部ウェル構造」は、メニスカスを抑制します。このため、血管新生実験だけではなく、位相差画像取得用途でも利用できます。
-
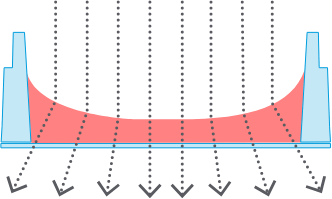
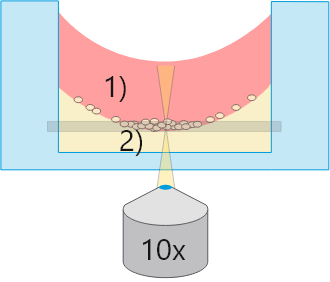 標準ウェル
標準ウェル1)メニスカスを生じた気-液界面
大部分の観察領域で位相差不良
2)ゲル表面のメニスカス
すべての細胞を同一焦点面で観察できない
-
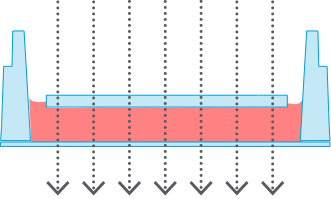
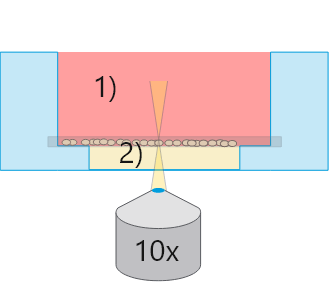 マイクロスライド/プレートアンジオジェネシス
マイクロスライド/プレートアンジオジェネシス1)平面の気-液界面
全観察領域で位相差良好
2)平らなゲル表面
すべての細胞が1つの光学平面にある
-
-
ibidi チャネルスライド
チャネルスライドは位相差顕微鏡観察に理想的です。細胞が播種されている状態では、チャネル内は培地で満たされているため、メニスカス形成はありません。このため、チャンネル全領域について、メニスカスフリーの位相差顕微鏡観察が可能です。
-
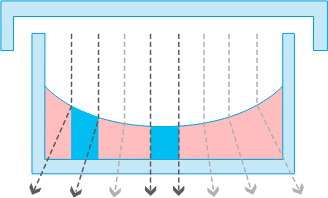 96 ウェルプレートなど小型オープンウェルフォーマットの容器
96 ウェルプレートなど小型オープンウェルフォーマットの容器強力なメニスカス、低コントラスト/位相差不良
-
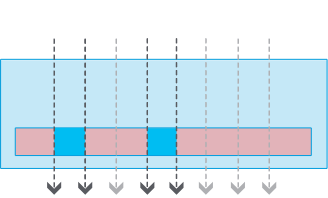 チャネルスライド
チャネルスライドメニスカスなし
全領域で良好な位相差
-
-
ibidi マイクロスライド Ph+
マイクロスライド Ph+は、位相差顕微鏡用途で、特別に設計されたスライドです。各ウェル内に配置されたプレートが、メニスカスの形成を妨げ、ウェルのどの部分においても鮮明な位相差画像を保証します。
-
 標準ウェル強力なメニスカス
標準ウェル強力なメニスカス -
 Ph+ ウェルメニスカスなし
Ph+ ウェルメニスカスなし
-
微分干渉(DIC)顕微鏡
用途:
原理:
DIC顕微鏡観察は、光の偏光を利用し、この位相変化を画像の強度(コントラスト)に変換します。この際、屈折率の異なる隣接構造が接する“境界”のみ、コントラストが強調されます。このため、この効果は微分と呼ばれています。この点、構造体のある“領域”が強調される位相差顕微鏡観察とは異なります。
位相差と比較すると、DIC顕微鏡観察はメニスカス形成の影響は受けにくいです。しかし、DIC顕微鏡観察は、光路に置く、スライドや蓋などの材質が、ibidiポリマーやガラスのような低複屈折である物質しか使えないという制限を受けます。このため、一般的な培養容器であるポリスチレン製プラスティックのディッシュなどはDIC顕微鏡観察に使用できません。
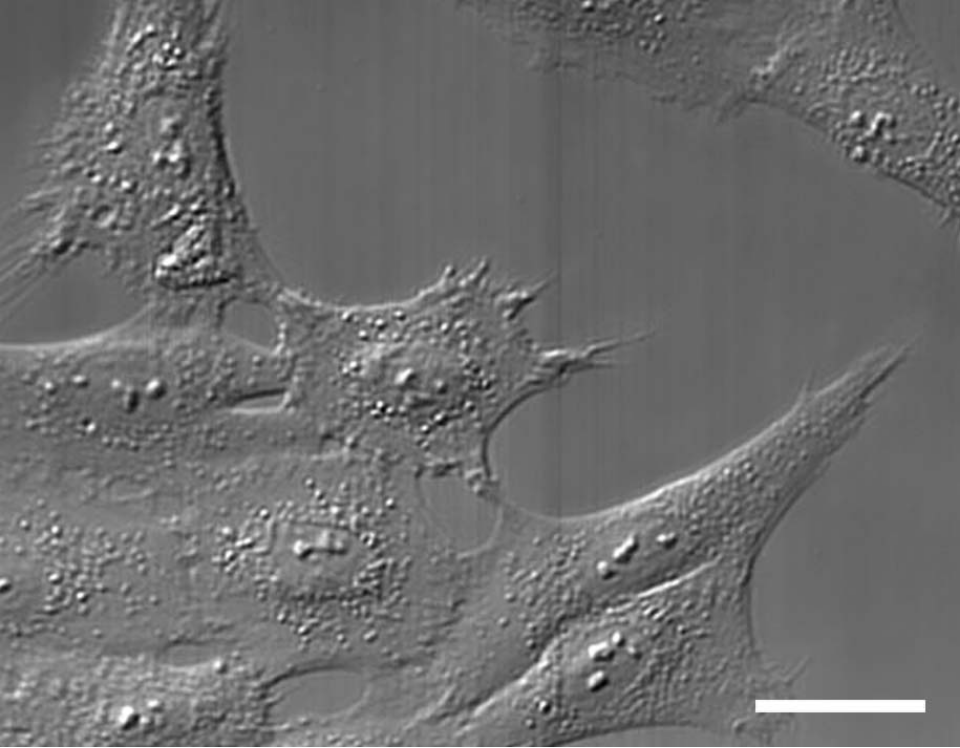 Rat1細胞のDIC顕微鏡像 スケールバー20 μm
Rat1細胞のDIC顕微鏡像 スケールバー20 μm ibidi Solution
- ibidiポリマーカバースリップはDIC顕微鏡観察適合素材です。
- ibidiガラスカバースリップもDIC顕微鏡に適合しています。
- ibidiは マイクロディッシュ用DIC Lidおよびマイクロスライド用DIC Lidを提供しています。 注意:マイクロディッシュおよびマイクロスライドに付いているフタは、DICに適合しないプラスティックが使用されています。このため、DIC専用のLidを販売しています。
• 注意: ibidi チャネルスライドはフレーム素材がDICに適合していないためDIC観察に用いることはできません。
広視野蛍光顕微鏡
用途:
蛍光顕微鏡観察は、細胞内の特定の構造、分子、またはタンパク質の検出に使用されます。生きている細胞や固定された組織を問わず、多くの対象に対し「蛍光標識」する手段が確立されており、標識ターゲット特異的な情報を取得するために用いられます。複数の蛍光色素を使用して、同時に複数のターゲットを可視化する場合もあります。
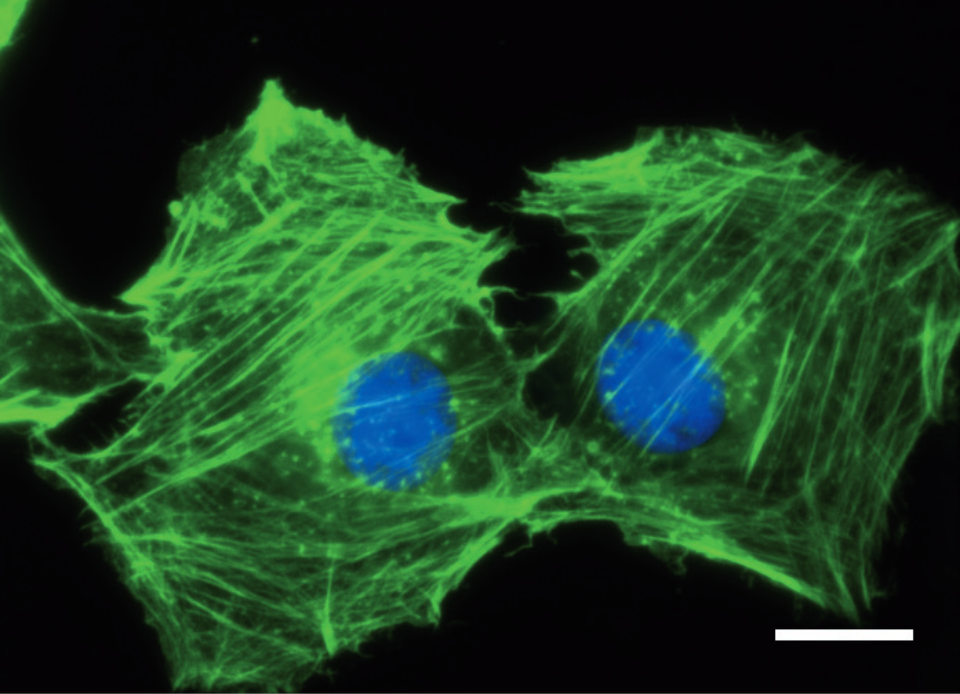 線維芽細胞をibidi ポリマー カバースリップ上で24時間培養後、パラホルムアルデヒドで固定した。固定したサンプルは、F−アクチンおよび核DNAをファロイジン(緑色)およびDAPI(青色)でそれぞれ染色し、観察を行った。使用した広視野蛍光顕微鏡、Carl Zeiss Axiovert 100、対物レンズPlan-Neolfluar 100x/1.3オイル、スケールバー10μm。
線維芽細胞をibidi ポリマー カバースリップ上で24時間培養後、パラホルムアルデヒドで固定した。固定したサンプルは、F−アクチンおよび核DNAをファロイジン(緑色)およびDAPI(青色)でそれぞれ染色し、観察を行った。使用した広視野蛍光顕微鏡、Carl Zeiss Axiovert 100、対物レンズPlan-Neolfluar 100x/1.3オイル、スケールバー10μm。 原理:
蛍光顕微鏡観察は、特定の細胞構造を観察するために、緑色蛍光タンパク質(GFP)など蛍光分子で標識することより始まります。蛍光分子は、特定波長の光を吸収し(励起)た後に、より長い波長(蛍光)を発します。このため、蛍光顕微鏡観察では、励起光と蛍光をフィルターで分離し観察します。分離が機能すると、暗色のバックグラウンドの中で、標識された構造が蛍光を発し、標識した分子が存在する構造体を可視化することができます。
広視野蛍光顕微鏡は励起~検出までを行うことのできる、最もシンプルな顕微鏡です。スポットに対し励起光を照射する共焦点顕微鏡とは対照的に、標本全体を一度で照射するため、焦点面全体からの蛍光シグナルを同時に検出します。このため、スフェロイドや組織のような厚い試料では低コントラストの画像となりがちで、接着細胞のような、バックグラウンドの要素が少ないサンプルで、よく使用されます。
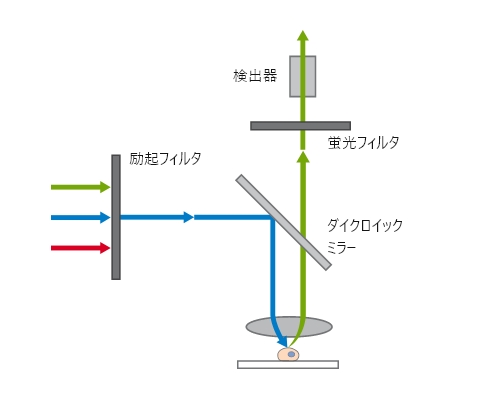
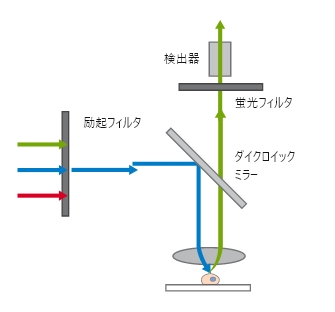 広視野顕微鏡の光路
広視野顕微鏡の光路 ibidi Solution
- ibidiポリマーカバースリップと ibidiガラスカバースリップは、蛍光顕微鏡観察に最適な素材です。いずれのibidiラボウェアも、 広視野蛍光顕微鏡観察に使用いただけます。
共焦点顕微鏡
用途:
共焦点顕微鏡は、広視野蛍光顕微鏡と同様に、蛍光分子で標識した、生細胞や固定した細胞、組織切片を蛍光観察する手法のひとつです。その分解能は大変高く、細胞内の詳細な構造を解明するために広く用いられています。
共焦点顕微鏡の特徴は、励起光を1点に絞るため、焦点領域外の蛍光をほとんど拾わないこと、および、正確な焦点深度の情報が得られる点にあります。このため、共焦点顕微鏡観察では、厚みのある構造の特定深度の情報を視覚化することができます。異なる焦点深度の複数の画像を重ねることで3D構造の解析にも利用されます。
しかし、共焦点顕微鏡を使用する場合、観察できる深度には限界があります。厚みのある 大きなスフェロイドやオルガノイド、組織、小動物のような厚みのあるものは、二光子顕微鏡やLSFMで撮影するのが最適です。
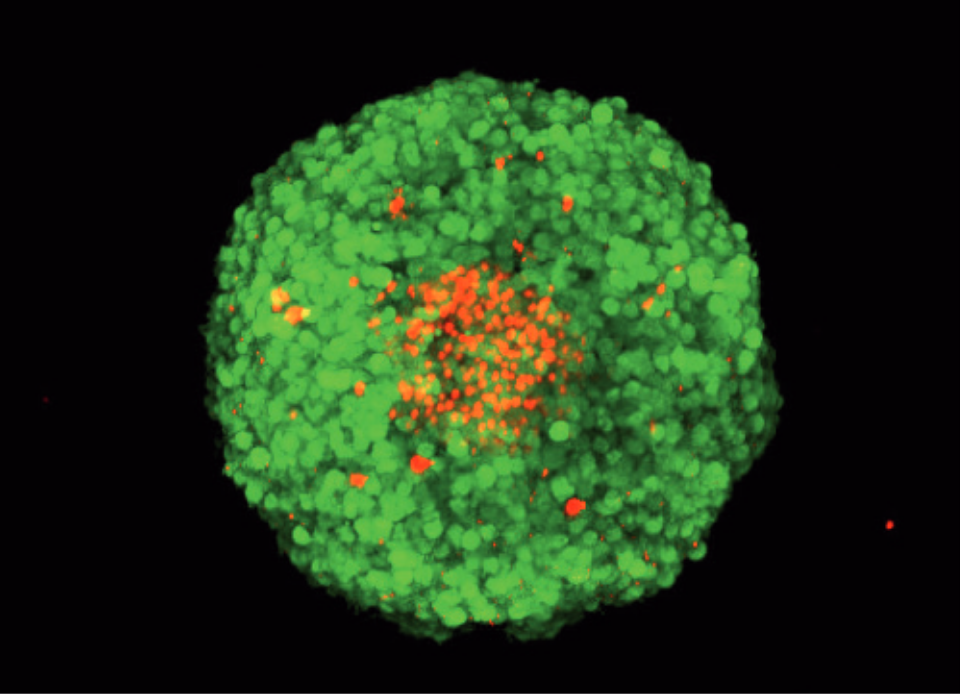 FDA/PI染色MCF-7スフェロイドのZ-スタック、共焦点顕微鏡による取得。緑色: FDA染色生細胞。赤色:スフェロイド中でPI染色された死細胞。
FDA/PI染色MCF-7スフェロイドのZ-スタック、共焦点顕微鏡による取得。緑色: FDA染色生細胞。赤色:スフェロイド中でPI染色された死細胞。 原理:
共焦点顕微鏡も蛍光検出の光学経路があります。広視野顕微鏡がサンプル全体を一度に照射するのに対し、共焦点顕微鏡では、レーザー光をサンプル内の特定深度で集光させます。これにより、サンプルの特定スポットのみ励起されます。さらに、光路上のピンホールが、スポット外の蛍光シグナルはカットされます。このため、共焦点顕微鏡では、励起スポット由来のシグナルだけを検出できます。
このスポットを動かし、ラスターパターンでスキャンすることにより、1つの光学面の画像が得られます。このようにして得られた画像をZ軸方向に積算すれば、立体的な観察対象を三次元で可視化することもできます。
また、異なる波長のレーザーや励起/蛍光フィルターを組み合わせることで、多色蛍光観察することも可能です。
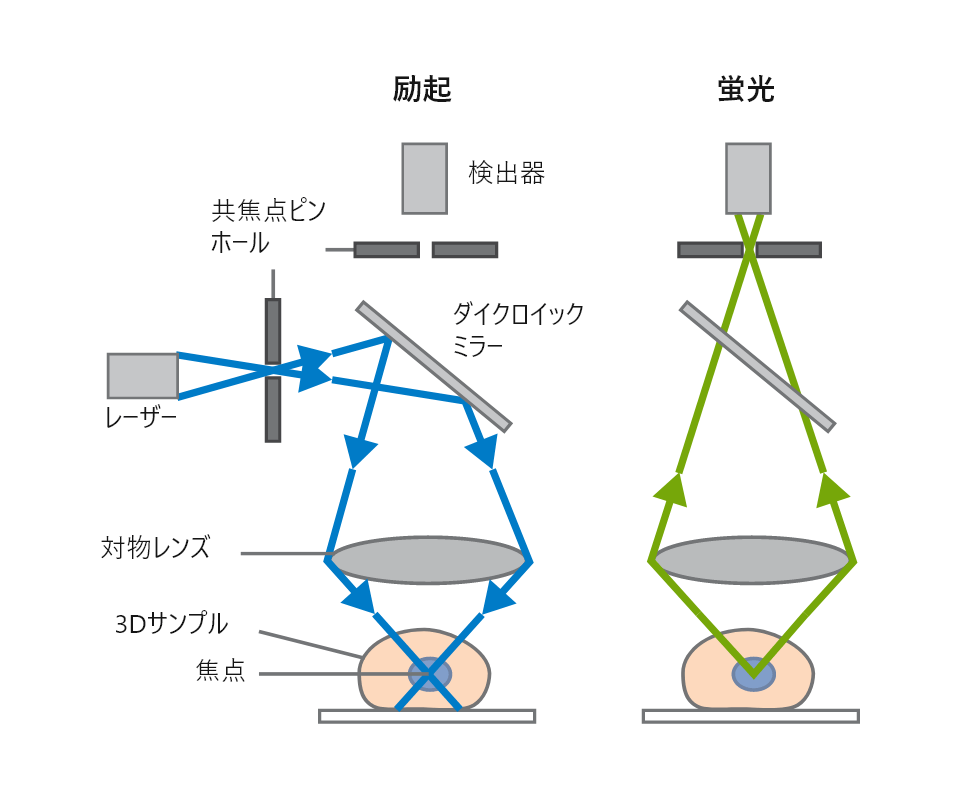
 共焦点顕微鏡の励起光と蛍光検出
共焦点顕微鏡の励起光と蛍光検出 ibidi Solution
- ibidiポリマーカバースリップと ibidiガラスカバースリップは、蛍光顕微鏡観察に最適な素材です。いずれのibidiラボウェアも、 共焦点蛍光顕微鏡観察に使用いただけます。
二光子顕微鏡
(多光子顕微鏡)
用途:
二光子顕微鏡(もしくは多光子顕微鏡)は、共焦点顕微鏡では観察できないレベルの厚い生体サンプルの観察に使用される顕微鏡技術です。最大約1mmまでサンプル内部を可視化でき、組織、オルガノイド、臓器、胚や動物全体などを対象とした3D画像化に使用されます。
共焦点顕微鏡と比較した場合、二光子顕微鏡は長波長の励起光を用いるため、光退色や励起に伴う細胞ダメージが少ない点も特徴で、生きた試料を扱う際のアドバンテージになります。
原理:
広視野蛍光顕微鏡や共焦点顕微鏡など、一般的な蛍光顕微鏡と同様に、二光子顕微鏡でも、蛍光分子を励起し、蛍光を取得します。しかしながら、二光子顕微鏡では、特定波長の光子1つで励起するのではなく、二つまたは複数個の光子を、同時に(一般的には数フェムト秒以内に)当てることで、蛍光分子を励起します。
この方法では、複数の光子が有するエネルギーを結合できるので、赤外線のような低エネルギーの光子でも、GFPのような蛍光分子を励起できます。赤外線は、蛍光顕微鏡で用いられる標準的な励起光よりも、透過力が強いため、深部観察の励起に適します。また、赤外線はエネルギーレベルが低いため、ダメージが少なく、励起することができます。
二光子励起では、2つの光子を同時に蛍光分子に当てる必要があるため、強度が高いレーザーを、特定のスポットに集中させます。十分な光子密度を実現できるのはこの焦点付近だけなので、励起が起こるのもこの領域に限定されます。従って、二光子顕微鏡で取得されるシグナルは、バックグラウンドノイズが非常に少なくなる点が特徴です。共焦点顕微鏡と同様に、スポットを動かしスキャンすることで画像を取得します。
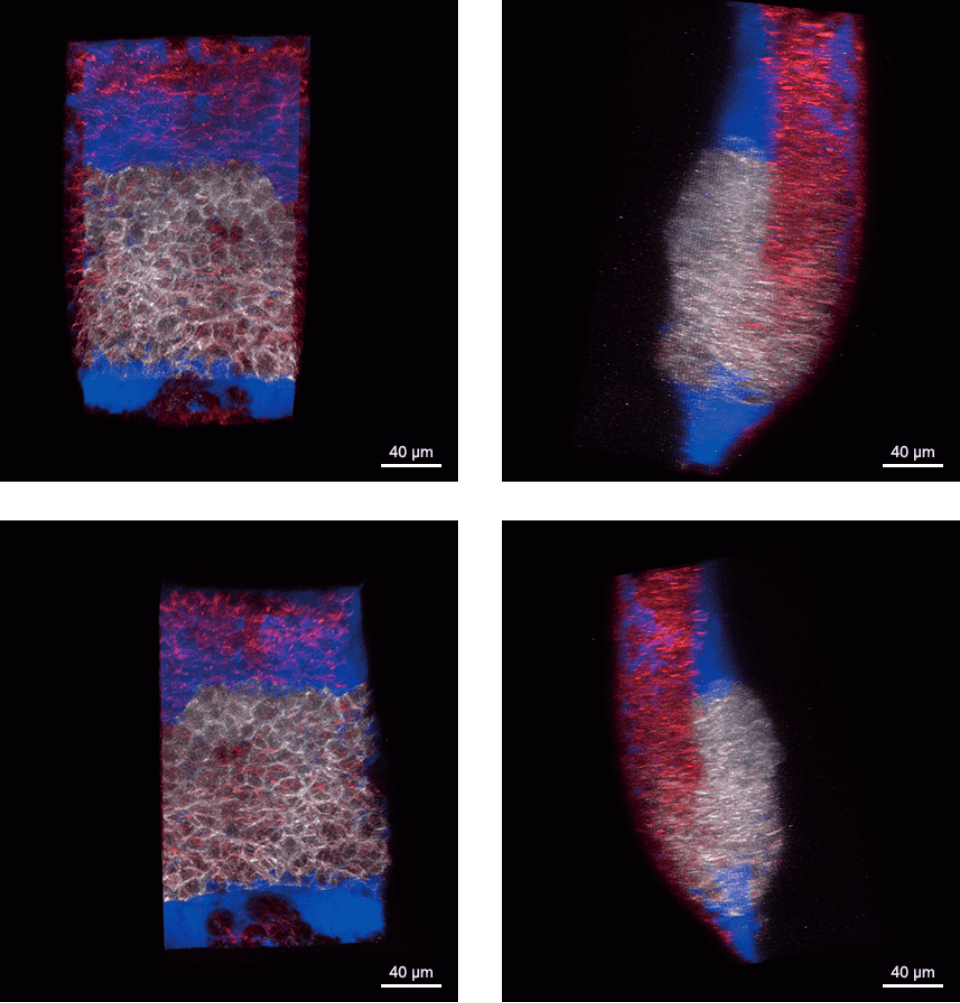 原腸陥入開始時(受精後6時間)のゼブラフィッシュ胚の背側胚輪の共焦点画像スタックを回転表示した画像。GFP (白色):脊索前板前駆細胞、lyn-TagBFP (赤色):細胞膜
原腸陥入開始時(受精後6時間)のゼブラフィッシュ胚の背側胚輪の共焦点画像スタックを回転表示した画像。GFP (白色):脊索前板前駆細胞、lyn-TagBFP (赤色):細胞膜胚にはデキストランローダミンを注入し、間質液(青色)を標識している。画像は、Bioimaging Facility of the Institute of Science and Technology Austria (IST)にて他光子顕微鏡LaVision BioTec TriM Scope microscopeで撮影。
- R.K.P. Benninger, D.W. Piston. Two-photon excitation microscopy for the study of living cells and tissues. Curr Protoc Cell Biol, 2013, 10.1002/0471143030.cb0411s5
ibidi Solution
- ibidiポリマーカバースリップと ibidiガラスカバースリップは、蛍光顕微鏡観察に最適な素材です。いずれのibidiラボウェアも、二光子顕微鏡観察に使用いただけます。
FRAP
(光褪色後蛍光回復法)
用途:
FRAPは、蛍光標識した分子の生細胞内における分子の拡散速度を調べるための蛍光観察手法です。細胞内の分子拡散、生体膜の流動性、タンパク結合の解析などに使用されます。
原理:
FRAP実験は、次の3つのステップで構成されます。
①観察領域の蛍光強度測定します。②観察領域にレーザービームを集束し、その領域の蛍光分子を退色させます。③分子拡散により周辺の蛍光分子と、領域内の光退色した分子の交換が起こり、観察領域の蛍光が回復します。この分子拡散速度が早いほど、この蛍光回復は早くなります。したがって、この蛍光回復速度を測定することによって、拡散係数と分子の移動速度を推定します。
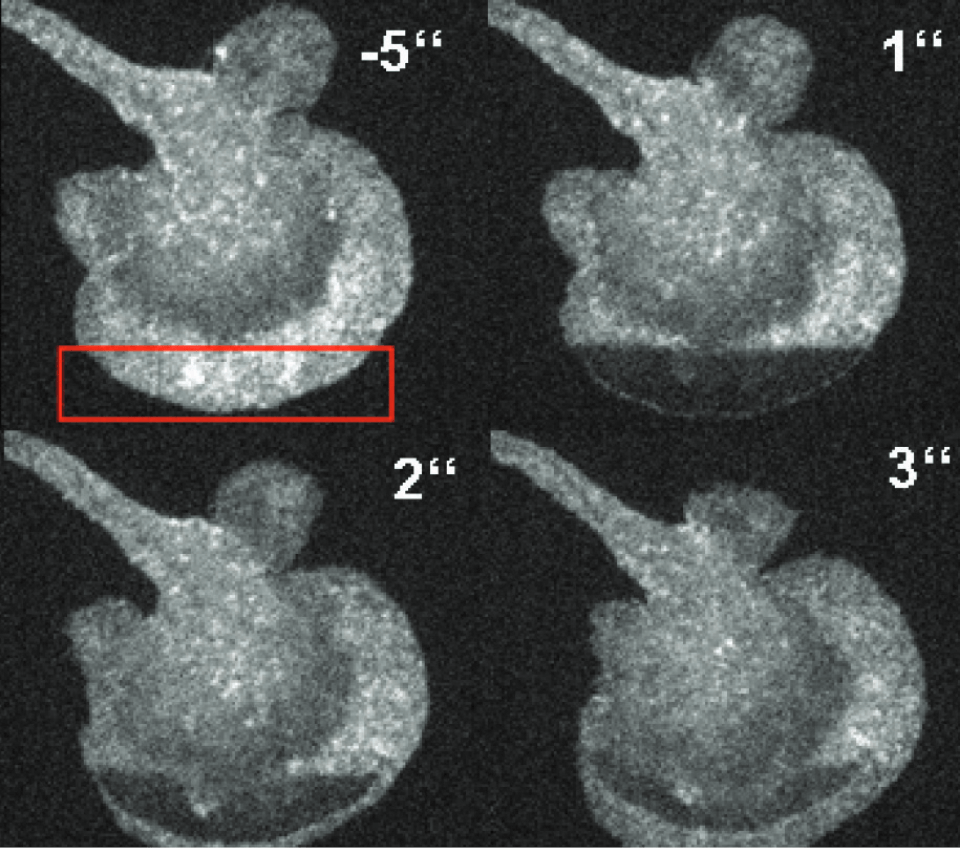 LifeActを用いた一次樹状細胞におけるF-アクチン拡散のFRAPでの可視化
LifeActを用いた一次樹状細胞におけるF-アクチン拡散のFRAPでの可視化 LSFM
(ライトシート蛍光顕微鏡)
用途:
LSFMは、胚、スフェロイド、オルガノイドや動物全体などを対象とした比較的厚い生体試料の生細胞3Dイメージングに使用されます。LSFMは、バックグランドシグナルが低いこと、光毒性を最小にできること、共焦点顕微鏡と比較してスキャン速度が速いなどのメリットがあり、厚い生体標本の分析にもちいる場合には、落射型蛍光顕微鏡よりも優れているとされます。
原理:
LSFM/SPIM (Single/Selective Plane Illumination Microscopy)にはいくつかの異なるシステムがあります。ただし、それらは共焦点蛍光顕微鏡や広視野蛍光顕微鏡とは異なる以下の共通する特徴を持っています。一つ目は、非常に薄いシート状に励起されることです。もう一つの違いは、励起と検出の光学経路が分離していることです。焦点以外の蛍光を拾わないように、照明に対して異なる軸(例えば、直交)で蛍光を検出します。不必要な焦点外蛍光分子は励起されず、スキャンされていない領域の光退色や光損傷を抑制することができます。さらに、LSFMでは、共焦点顕微鏡のようなスポットのスキャンではなく、平面スキャンで画像を取得します(光学的切片法)。このため、スキャン速度は高速です。
このような特性より、低細胞ストレス、低バックグラウンド蛍光、および時間節約などがメリットとして挙げられ、繊細な生体試料の3D生細胞イメージングを行う場合に有用な手法となります。
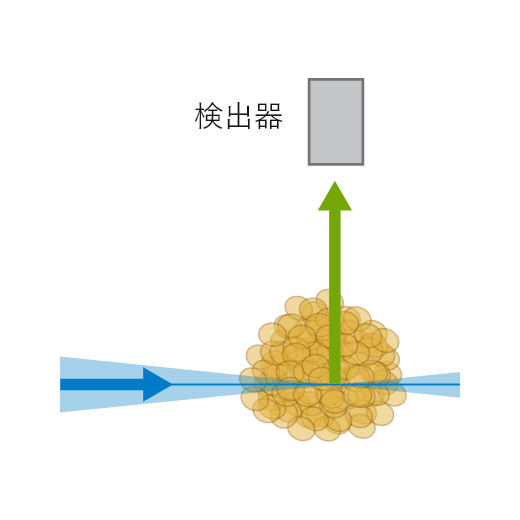
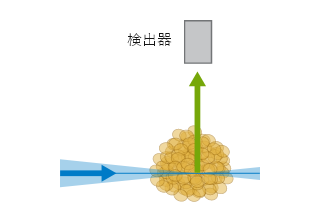 LSFMの原理設定
LSFMの原理設定 ibidi Solution
ibidiポリマーカバースリップと ibidiガラスカバースリップは、蛍光顕微鏡観察に最適な素材です。いずれのibidiラボウェアも、FRAPにご使用いただけます。また、LSFM観察にも適合できる可能性があります。
注意:LSFMに適合できるかどうかは、容器の形状、使用されるLSFMシステムおよびその光路設定によって異なります。このため、厳密には個別にチェックする必要があります。
FRET
(フェルスター共鳴エネルギー遷移)
用途:
FRETは、2つの異なる蛍光分子の空間的近接性がわかるため、標識ターゲットの相互作用を評価するために使用できます。例えば、タンパク質-タンパク質相互作用またはタンパク質のコンホメーション変化を分析するために使用されます。また、細胞内カルシウム濃度変化の可視化に利用されるなど、FRETを応用した細胞内特定物質のバイオセンサーとしても利用されます。観察は、広視野顕微鏡や共焦点蛍光顕微鏡などを用いることが一般的です。
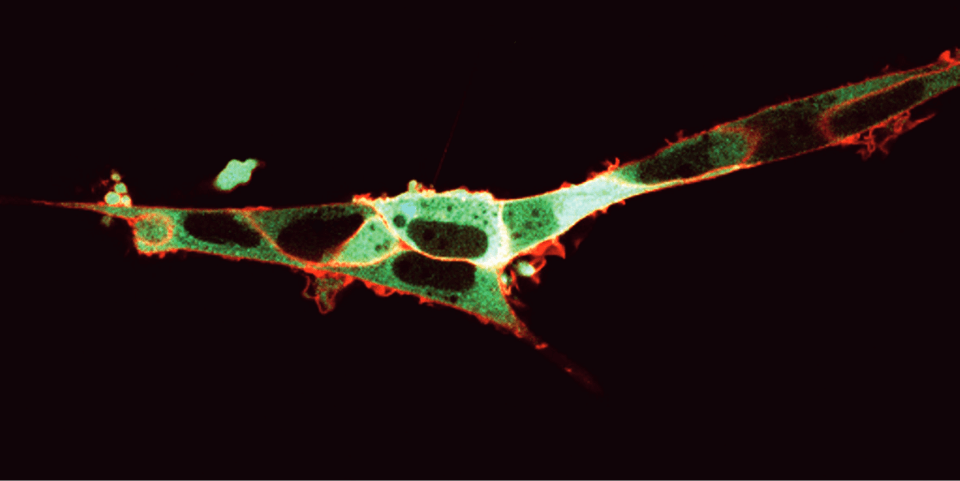 FRETを用いた細胞質カルシウム濃度の可視化 細胞外膜にNK-Iを発現させ、細胞質にカルシウムバイオセンサーYellow Cameleon 3.6(YC3.6) を発現させたHEK293細胞。蛍光標識したNK-Iリガンド(SP-TAMRA)を加えると、細胞膜が赤く光る。受容体が活性化されると、カルシウム放出が起こり、YC3.6蛍光特性変化を誘導します: CFPの励起はFRETによりCFPとYFPに分配され蛍光を放出します。この結果、FRETの起こった細胞質が緑色に観察されます。M. Roelse, Wageningen, The Netherlandsより提供。
FRETを用いた細胞質カルシウム濃度の可視化 細胞外膜にNK-Iを発現させ、細胞質にカルシウムバイオセンサーYellow Cameleon 3.6(YC3.6) を発現させたHEK293細胞。蛍光標識したNK-Iリガンド(SP-TAMRA)を加えると、細胞膜が赤く光る。受容体が活性化されると、カルシウム放出が起こり、YC3.6蛍光特性変化を誘導します: CFPの励起はFRETによりCFPとYFPに分配され蛍光を放出します。この結果、FRETの起こった細胞質が緑色に観察されます。M. Roelse, Wageningen, The Netherlandsより提供。 原理:
ある蛍光分子(ドナー)の蛍光スペクトルと,もうひとつの蛍光分子(アクセプター)の励起スペクトルに重なりがあることが、FRETが起こるための要件になります。要件を満たす2つの蛍光分子が近接すると、ドナーとなる蛍光分子が励起状態される際に、アクセプターである蛍光分子にその励起エネルギーが移動し、蛍光が発せられるようになります。通常、FRETは10 nm未満の距離(フェルスター半径)で起こります。
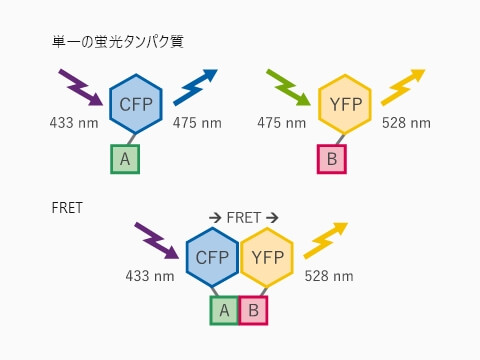
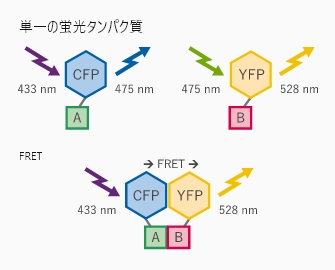 FRETタンパク質相互作用アッセイ模式図 受容体AとそのリガンドBを、それぞれCFPとYFPで標識している。リガンドが受容体に結合すると、YFPはFRETによって蛍光を発する。
FRETタンパク質相互作用アッセイ模式図 受容体AとそのリガンドBを、それぞれCFPとYFPで標識している。リガンドが受容体に結合すると、YFPはFRETによって蛍光を発する。 FLIM
(蛍光寿命イメージング)
用途:
FLIMは、タンパク質や核酸などの特定分子の状態およびその分布を可視化する手法です。細胞内のカルシウムイオン量、pH、酸素濃度、および分子間相互作用などの測定に用いられます。光学条件しだいでは、一分子レベルの検出もできます。標準的な蛍光顕微鏡観察と比較して、FLIMが扱うことができる深度は高く、厚い試料の分析も可能です。
原理:
蛍光強度分布が取得画像に反映される一般的な蛍光顕微鏡とは対照的に、FLIMは、蛍光分子から発せられる光の減衰を分析し、蛍光寿命を測定します。蛍光寿命は、励起状態に留る時間、つまり、蛍光分子の励起が起こってから、光子を放出し、基底状態に戻るまでの平均時間として定義されます。
蛍光寿命は分子間相互作用やイオン濃度などの蛍光分子が存在する局所環境に依存します。一方で、蛍光分子の濃度変化、FRETのアクセプター分子が近接しているときにも減少します。この性質を利用して、FLIMとFRETの組み合わせることで、精度の高い分子間相互作用の測定にも利用されます。
- H.C. Ishikawa-Ankerhold, R. Ankerhold, G.P.C. Drummen. Advanced Fluorescence Microscopy Techniques—FRAP, FLIP, FLAP, FRET and FLIM. Molecules, 2012, 10.3390/molecules17044047
ibidi Solution
ibidiポリマーカバースリップと ibidiガラスカバースリップは、蛍光顕微鏡観察に最適な素材です。いずれのibidiラボウェアも、FRETおよびFLIM測定に使用することが可能です。
全反射照明蛍光顕微鏡(TIRF)
用途:
TIRFは、生細胞の膜表面や付近で起こる過程を画像化するのに用いられる蛍光観察技術です。TIRFは焦点深度が浅く、サンプルの奥深くに位置する構造体の観察には用いることはできません。一方で、非常に良いS/N比で、膜近傍を画像化することができます。このため、TIRFは、受容体-リガンド相互作用、エンドサイトーシス、ウイルス感染、細胞接着など、膜表面で起こる生命現象を可視化するために用いられます。
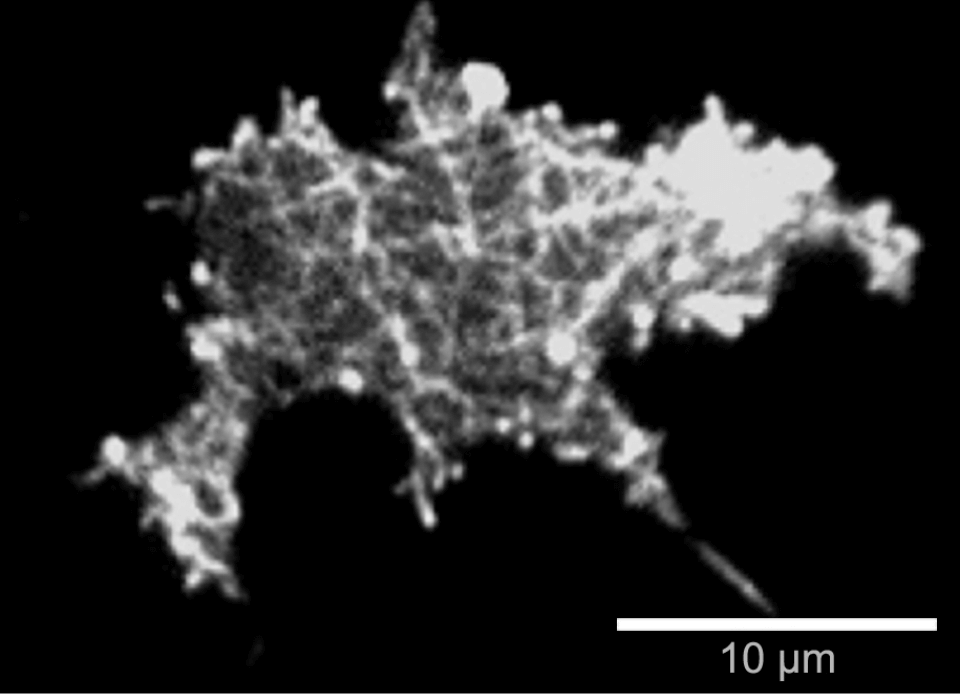 Dictyostelium discoideum DdLimE-GFP細胞のTIRFによる生細胞イメージング。表面近傍に形成されたF‐アクチンネットワークが確認できる。 ガラスカバースリップ#1.5H使用。
Dictyostelium discoideum DdLimE-GFP細胞のTIRFによる生細胞イメージング。表面近傍に形成されたF‐アクチンネットワークが確認できる。 ガラスカバースリップ#1.5H使用。 原理:
TIRFには、水(nD=1.33)とガラス(nD=1.52)のような屈折率の異なる2種類の光学媒体が必要です。入射光の全反射がこれらの媒体の界面で発生した場合、エバネッセント場が形成されます。このエバネッセント場を利用することで、試料の深さ約100~200 nmの領域にある蛍光分子の励起に利用できます。したがって、カバーガラスと試料の界面で起こる蛍光のみが可視化されます。
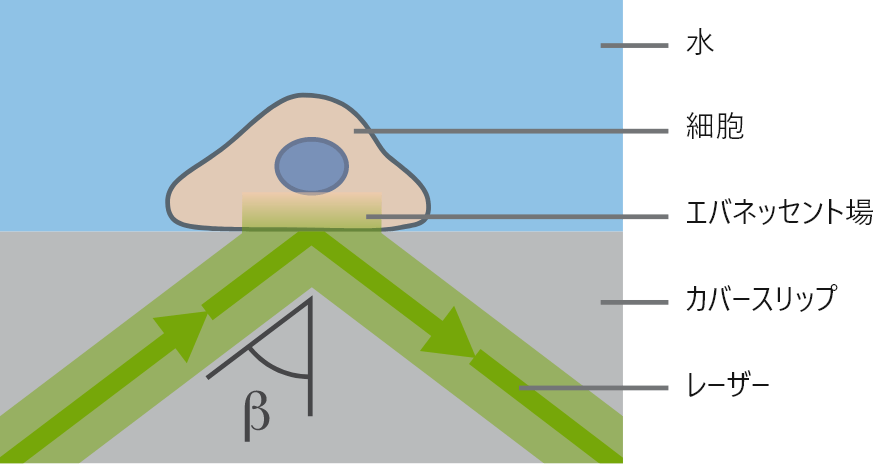
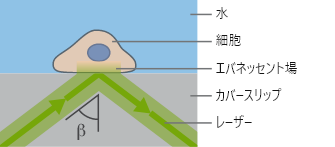 TIRF顕微鏡の原理
TIRF顕微鏡の原理 ibidi Solution
- TIRF顕微鏡観察では、ibidi ガラスカバースリップを推奨しています。
- すべてのガラスカバースリップが採用されたibidiラボウェアでは、TIRFに使用することが可能です。
超解像顕微鏡観察
(STED、SIM、
(F)PALM、(d)STORM)
用途:
超解像顕微鏡は、一般的な広視野または共焦点蛍光顕微鏡では分析できない分解能で、細胞内構造体を可視化します。この技術では、光の回折限界をはるかに超える空間的な分解能が得られます。
原理:
- ・Stimulated emission depletion (STED)
- ・Saturated structured illumination microscopy (SSIM)
- ・REversible Saturable Optical Linear Fluorescence Transitions (RESOLFT)
- ・Photoactivated localization microscopy (PALM)
- ・Fluorescence photoactivation localization microscopy (FPALM)
- ・(d)STORMStochastic optical reconstruction microscopy (d)STORM
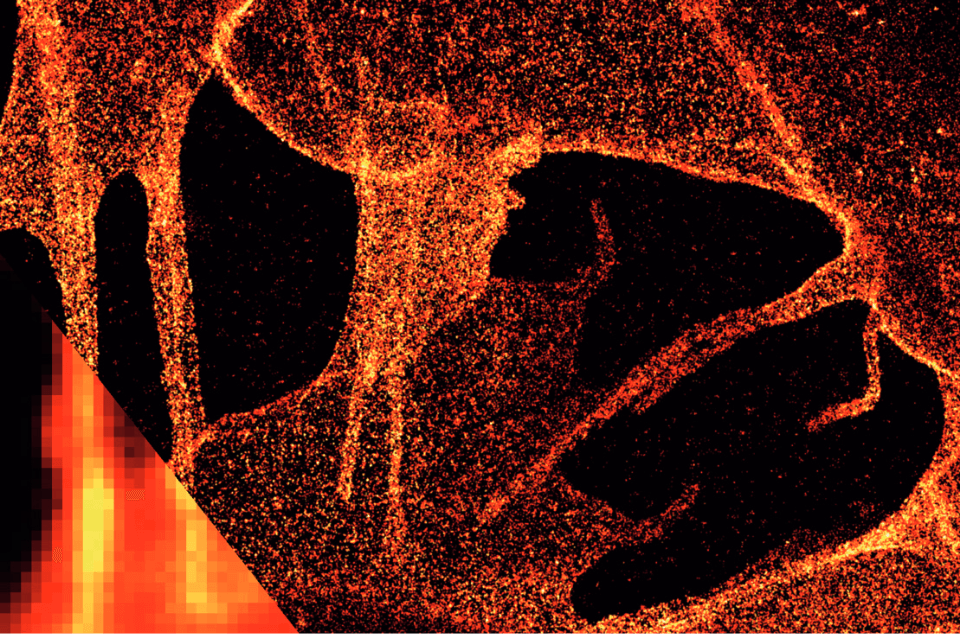 ibidi ポリマーカバースリップ上の細胞膜グリカンのdSTORM像。SK‐N‐MC神経芽細胞腫細胞の膜グリカンを、アジド‐糖類似体の代謝取込とそれに続く銅触媒アジデアルキルシクロ付加(CuAAC)を介して染色した。左下:広視野顕微鏡との比較。Würzburg, Markus Sauer より提供。
ibidi ポリマーカバースリップ上の細胞膜グリカンのdSTORM像。SK‐N‐MC神経芽細胞腫細胞の膜グリカンを、アジド‐糖類似体の代謝取込とそれに続く銅触媒アジデアルキルシクロ付加(CuAAC)を介して染色した。左下:広視野顕微鏡との比較。Würzburg, Markus Sauer より提供。 - S.W. Hell. Far-field optical nanoscopy. Science, 2007, 10.1126/ science.1137395
- S.W. Hell. Microscopy and its focal switch. Nat Methods, 2009, 10.1038/ nmeth.1291
- B. Huang, H. Babcock, X. Zhuang. Breaking the diffraction barrier: super-resolution imaging of cells. Cell, 2010, 10.1016/j. cell.2010.12.002
- S.J. Sahl, S.W. Hell, S. Jakobs. Fluorescence nanoscopy in cell biology. Nat Rev Mol Cell Biol, 2017, 10.1038/nrm.2017.71
ibidi Solution
超解像顕微鏡観察では、ibidi ガラスカバースリップを推奨しています。
すべてのガラスカバースリップが採用されたibidiラボウェアでは、超解像顕微鏡観察に使用することが可能です。 注意:dSTORMはibidi ポリマーカバースリップで使用実績があります。
ibidi ポリマーカバースリップでお試しされるのであれば、無料サンプルをご提供いたします。お気軽にお問合せください。


